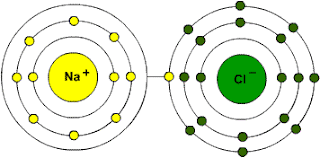
Se denomina agente oxidante a aquella sustancia que se reduce provocando en la otra una perdida de electrones.
Se le llama agente reductor a aquella sustancia que sufre una oxidación, es decir, pierde electrones.
jueves, 28 de marzo de 2013
lunes, 25 de marzo de 2013
La oxidación un tipo de cambio químico.
La oxidación comúnmente se define como resultado de la interacción entre el oxigeno y las diversas sustancias. Sin embargo, oxidación es un proceso que va más allá se presenta junto con una reducción es decir, cuando hay una reacción química una de las especies gana electrones (reducción) y la otra pierde electrones (oxidación).
viernes, 22 de marzo de 2013
El yeso.
El yeso, piedra de yeso, yeso crudo, yeso natural o aljez, es
un mineral compuesto de sulfato de calcio hidratado, también una roca
sedimentaria de origen químico.
Este producto se obtiene a traves de la siguiente reaccion:
CaCO3 + H2SO4 ------- CaSO4
+ H2O
Su fórmula química es:
CaSO4 “Sulfato de calcio”
Y su reaccion de neutralizacion es:
H2SO4 + Ca (OH)2
CaSO4 + 2H2O


lunes, 18 de marzo de 2013
Ejemplo de una reaccion de neutralización.
Como ya sabemos una reaccion de neutralizacion es una reaccion entre un acido y una base, de la cual se obtiene como resultado sal y agua.
Un ejemplo puede ser cuando a una persona le da una indigestion en el estomago, es decir, cuando hay un exceso de acido en el estomago y el cual se debe contrarrestar con una base, en este caso se utiliza como base al bicarbonato de sodio.
Una forma de representar lo anterior seria usando como acido al vinagre y como base para contrarrestarlo al bicarbonato, y del cual el resultado seria la sal y el agua.

Un ejemplo puede ser cuando a una persona le da una indigestion en el estomago, es decir, cuando hay un exceso de acido en el estomago y el cual se debe contrarrestar con una base, en este caso se utiliza como base al bicarbonato de sodio.
Una forma de representar lo anterior seria usando como acido al vinagre y como base para contrarrestarlo al bicarbonato, y del cual el resultado seria la sal y el agua.

jueves, 14 de marzo de 2013
Ejemplos de ácidos y bases.
A continuación algunos ejemplos de ácidos y bases.
|
Compuesto.
|
Ácido o base.
|
Nombre.
|
|
HCL
|
Ácido.
|
Ácido
clorhídrico.
|
|
HF
|
Ácido.
|
Ácido
fluorhídrico.
|
|
H3PO4
|
Ácido.
|
Ácido
fosfático.
|
|
NaOH
|
Base.
|
Hidróxido
de sodio.
|
|
Mg(OH)2
|
Base.
|
Hidróxido
de magnesio.
|
|
H2SO4
|
Ácido.
|
Ácido
sulfúrico.
|
lunes, 11 de marzo de 2013
Reacción de Neutralización.
Una reacción de neutralización es una
reacción entre un ácido y una base, generalmente en las reacciones acuosas
ácido-base se forma agua y una sal, un ejemplo es el producto de la reacción ácido-base del HCl con NaOH
HCl
(ac) + NaOH (ac) NaCl (ac) + H2O (liq)
jueves, 7 de marzo de 2013
Indicadores.
Para saber si una sustancia es acida o basica se utilizan
los indicadores.
Estos sirven para obtener información sobre el grado de
acidez o pH de una sustancia, o sobre el estado de una reacción química en una
disolución que se está valorando o analizando. Uno de los indicadores más
antiguos es el tornasol, un tinte vegetal que adquiere color rojo en las
disoluciones ácidas y azul en las básicas. Los indicadores pueden ser
naturales o artificiales.
A continuacion algunos indicadores:
- Bugambilia:
- Col morada:
- Jamaica:
- Fenolftaleina:
lunes, 4 de marzo de 2013
Propiedades de acidos y bases.
Ácidos:
- Conducen la corriente eléctrica cuando están disueltos en agua.
- Algunos metales (Zn, Mg, etc.) reaccionan con los ácidos desprendiendo hidrógeno (H2).
- Presentan sabor agrio, el denominado sabor ácido.
- Reaccionan con el mármol, desprendiendo CO2.
- Modifican el color de las sustancias denominadas indicadores (color rojo).
- Aceptan pares de electrones.
Bases:
- Conducen la corriente eléctrica cuando están disueltos en agua.
- Tienen sabor amargo y son untuosas al tacto.
- Reaccionan con los ácidos produciendo sustancias totalmente diferentes (sales).
- Modifican el color de las sustancias denominadas indicadores (color azul).
- Inflamables.
- Adoptan pares de electrones.
Suscribirse a:
Entradas (Atom)