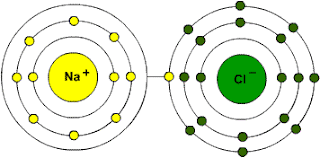
HCl
(ac) + NaOH (ac) NaCl (ac) + H2O (liq)
lunes, 11 de marzo de 2013
Reacción de Neutralización.
Una reacción de neutralización es una
reacción entre un ácido y una base, generalmente en las reacciones acuosas
ácido-base se forma agua y una sal, un ejemplo es el producto de la reacción ácido-base del HCl con NaOH
jueves, 7 de marzo de 2013
Indicadores.
Para saber si una sustancia es acida o basica se utilizan
los indicadores.
Estos sirven para obtener información sobre el grado de
acidez o pH de una sustancia, o sobre el estado de una reacción química en una
disolución que se está valorando o analizando. Uno de los indicadores más
antiguos es el tornasol, un tinte vegetal que adquiere color rojo en las
disoluciones ácidas y azul en las básicas. Los indicadores pueden ser
naturales o artificiales.
A continuacion algunos indicadores:
- Bugambilia:
- Col morada:
- Jamaica:
- Fenolftaleina:
lunes, 4 de marzo de 2013
Propiedades de acidos y bases.
Ácidos:
- Conducen la corriente eléctrica cuando están disueltos en agua.
- Algunos metales (Zn, Mg, etc.) reaccionan con los ácidos desprendiendo hidrógeno (H2).
- Presentan sabor agrio, el denominado sabor ácido.
- Reaccionan con el mármol, desprendiendo CO2.
- Modifican el color de las sustancias denominadas indicadores (color rojo).
- Aceptan pares de electrones.
Bases:
- Conducen la corriente eléctrica cuando están disueltos en agua.
- Tienen sabor amargo y son untuosas al tacto.
- Reaccionan con los ácidos produciendo sustancias totalmente diferentes (sales).
- Modifican el color de las sustancias denominadas indicadores (color azul).
- Inflamables.
- Adoptan pares de electrones.
jueves, 28 de febrero de 2013
Concepto de Arrhenius para ácidos y bases.
La primer definición de ácidos y bases fue dada por el
químico sueco Svante Arrhenius alrededor de 1884 enunciando que:
“Las sustancias ácidas son aquellas que en solución acuosa se disocian en iones hidrógeno; mientras que las sustancias básicas son aquellas que en solución acuosa se disocian en iones hidróxilos”
La teoría de Arrhenius de ácidos y bases fue formulada con base en su teoría de ionización de las sustancias en soluciones acuosas. Las sustancias que se disociaban totalmente o parcialmente como iones en solución acuosa eran considerados electrolitos. Aquellas que se disociaban totalmente eran electrolitos fuertes, las que no se disociaban totalmente eran electrolitos débiles.
En el caso de los ácidos fuertes, tales como H2SO4, HNO3, HCl, HClO4, los cuales se ionizan completamente en solución acuosa y proveen iones hidrógeno (H+), la teoría de Arrhenius funcionaba perfectamente.
“Las sustancias ácidas son aquellas que en solución acuosa se disocian en iones hidrógeno; mientras que las sustancias básicas son aquellas que en solución acuosa se disocian en iones hidróxilos”
La teoría de Arrhenius de ácidos y bases fue formulada con base en su teoría de ionización de las sustancias en soluciones acuosas. Las sustancias que se disociaban totalmente o parcialmente como iones en solución acuosa eran considerados electrolitos. Aquellas que se disociaban totalmente eran electrolitos fuertes, las que no se disociaban totalmente eran electrolitos débiles.
En el caso de los ácidos fuertes, tales como H2SO4, HNO3, HCl, HClO4, los cuales se ionizan completamente en solución acuosa y proveen iones hidrógeno (H+), la teoría de Arrhenius funcionaba perfectamente.
De modo semejante, las
bases fuertes como NaOH y KOH también se ionizaban completamente en solución
acuosa y producen iones hidrófilos (OH-)
lunes, 25 de febrero de 2013
Balanceo de ecuaciones quimicas.
Balancear o ajustar una ecuacion quimica es obtener los coheficientes indicados para que en nuestra reaccion se cumpla la ley de la conservacion de la materia enunciada por Lavoisier que en pocas palabras explica que: En una reaccion la cantidad de atomos de un elemento en reactivos debe ser igual a la cantidad obtenida en los productos.
Ejemplo:
2HNO3 ---- N2 O5 + H2 O
Ejemplo:
jueves, 21 de febrero de 2013
Tabla de radicales.
|
Radical.
|
Nombre.
|
Numero
de oxidación.
|
|
HCO3
|
Carbonato acido.
|
-1
|
|
CO3
|
Carbonato.
|
-2
|
|
ClO3
|
Cloro.
|
-1
|
|
OH
|
Hidróxido.
|
-1
|
|
NO3
|
Nitrato.
|
-1
|
|
MnO4
|
Permanganato.
|
-1
|
|
CrO4
|
Cromato.
|
-2
|
|
SiO3
|
Silicato.
|
-2
|
|
SO4
|
Sulfato.
|
-2
|
|
BO3
|
Borato.
|
-3
|
|
PO4
|
Fosfato.
|
-3
|
lunes, 18 de febrero de 2013
Conceptos.
Reaccion quimica: Es la interaccion entre dos o mas sustancias que al sufrir un cambio dan origen a otras totalmente diferentes a las que le dieron origen.
Ecuacion quimica: Es la representacion escrita de una reaccion quimica.
Reactivos: Sustancias iniciales para formar un producto.
Productos: Es el resultado que da las sustancias finales.
Formula quimica: Es la representacion escrita y simbolica de la molecula de una sustancia.
Simbolo: Es la represetacion escrita de un elemento.
Elemento: Es una sustancia que no se descompone quimicamente en otras sustancias mas simples.
Compuesto: Una sustancia que puede hacerse apartir de un elemento.
Molecula: Union de dos o mas atomos, representativo de un compuesto.
Ecuacion quimica: Es la representacion escrita de una reaccion quimica.
Reactivos: Sustancias iniciales para formar un producto.
Productos: Es el resultado que da las sustancias finales.
Formula quimica: Es la representacion escrita y simbolica de la molecula de una sustancia.
Simbolo: Es la represetacion escrita de un elemento.
Elemento: Es una sustancia que no se descompone quimicamente en otras sustancias mas simples.
Compuesto: Una sustancia que puede hacerse apartir de un elemento.
Molecula: Union de dos o mas atomos, representativo de un compuesto.
Suscribirse a:
Entradas (Atom)