La materia esta formada por moléculas que pueden ser de tamaño normal o moléculas gigantes llamadas polímeros.
Los polímeros se producen por la unión de cientos de miles de moléculas pequeñas denominadas monómeros que forman enormes cadenas de las formas más diversas. Algunas parecen fideos, otras tienen ramificaciones. algunas más se asemejan a las escaleras de mano y otras son como redes tridimensionales.
Existen polímeros naturales de gran significación comercial como el algodón, formado por fibras de celulosas. La celulosa se encuentra en la madera y en los tallos de muchas plantas, y se emplean para hacer telas y papel. La seda es otro polímero natural muy apreciado y es una poliamida semejante al nylon. La lana, proteína del pelo de las ovejas, es otro ejemplo. El hule de los árboles de hevea y de los arbustos de Guayule, son también polímeros naturales importantes.
Sin embargo, la mayor parte de los polímeros que usamos en nuestra vida diaria son materiales sintéticos con propiedades y aplicaciones variadas.
Lo que distingue a los polímeros de los materiales constituídos por moléculas de tamaño normal son sus propiedades mecánicas. En general, los polímeros tienen una excelente resistencia mecánica debido a que las grandes cadenas poliméricas se atraen. Las fuerzas de atracción intermoleculares dependen de la composición química del polímero y pueden ser de varias clases.
jueves, 25 de abril de 2013
lunes, 22 de abril de 2013
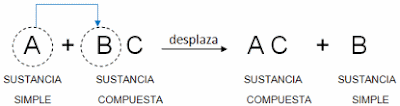
Reacción de sustitución simple o desplazamiento.
Cuando un elemento por afinidad química reemplaza en el compuesto a aquel que tenga el mismo tipo de valencia, se origina una reacción por sustitución simple o desplazamiento.
Su formula general es: A + BC → AC + B. Cuando una sustancia simple reacciona con otra compuesta, reemplazando a uno de sus componentes. Sustitución simple. Se forma por intercambio de iones entre dos compuestos ejemplo: Cu + Ag NO3 Cu NO3 + Ag.
En general se presenta cuando un elemento químico mas activo o mas reactivo desplaza a otro elemento menos reactivo que se encuentra formando parte de un compuesto; el elemento que a sido desplazado queda en forma libre.
En el caso de los metales, los mas activos son los metales alcalinos y metales alcalinos térreos.
En el caso de los no metales, los mas reactivos son algunos halogenos : Fl2 , Cl2 , Br2 ; además del oxígeno y el fósforo.
Su formula general es: A + BC → AC + B. Cuando una sustancia simple reacciona con otra compuesta, reemplazando a uno de sus componentes. Sustitución simple. Se forma por intercambio de iones entre dos compuestos ejemplo: Cu + Ag NO3 Cu NO3 + Ag.
En general se presenta cuando un elemento químico mas activo o mas reactivo desplaza a otro elemento menos reactivo que se encuentra formando parte de un compuesto; el elemento que a sido desplazado queda en forma libre.
En el caso de los metales, los mas activos son los metales alcalinos y metales alcalinos térreos.
En el caso de los no metales, los mas reactivos son algunos halogenos : Fl2 , Cl2 , Br2 ; además del oxígeno y el fósforo.
jueves, 18 de abril de 2013
Electronegatividad.
La electronegatividad de un elemento mide su tendencia a atraer hacia sí electrones, cuando está químicamente combinado con otro átomo. Cuanto mayor sea, mayor será su capacidad para atraerlos.
Pauling la definió como la capacidad de un átomo en una molécula para atraer electrones hacia así. Sus valores, basados en datos termoquímicos, han sido determinados en una escala arbitraria, denominada escala de Pauling, cuyo valor máximo es 4 que es el valor asignado al flúor, el elemento más electronegativo. El elemento menos electronegativo, el cesio, tiene una electronegatividad de 0,7.
La electronegatividad de un átomo en una molécula está relacionada con su potencial de ionización y su electroafinidad.
Un átomo con una afinidad electrónica muy negativa y un potencial de ionización elevado, atraerá electrones de otros átomos y además se resistirá a dejar ir sus electrones ante atracciones externas; será muy electronegativo.
Pauling la definió como la capacidad de un átomo en una molécula para atraer electrones hacia así. Sus valores, basados en datos termoquímicos, han sido determinados en una escala arbitraria, denominada escala de Pauling, cuyo valor máximo es 4 que es el valor asignado al flúor, el elemento más electronegativo. El elemento menos electronegativo, el cesio, tiene una electronegatividad de 0,7.
La electronegatividad de un átomo en una molécula está relacionada con su potencial de ionización y su electroafinidad.
Un átomo con una afinidad electrónica muy negativa y un potencial de ionización elevado, atraerá electrones de otros átomos y además se resistirá a dejar ir sus electrones ante atracciones externas; será muy electronegativo.
lunes, 15 de abril de 2013
Regla del Octeto.
La regla del octeto establece que los átomos de los elementos se enlazan unos a otros en el intento de completar su capa de valencia (ultimo nivel de electrones).
La denominación “regla del octeto” surgió en razón de la cantidad establecida de electrones para la estabilidad de un elemento, o sea, el átomo queda estable cuando presenta en su capa de valencia 8 electrones.
Para alcanzar tal estabilidad sugerida por la regla del octeto, cada elemento precisa ganar o perder (compartir) electrones en los enlaces químicos, de esa forma ellos adquieren ocho electrones en la capa de valencia.
Por ejemplo:
La denominación “regla del octeto” surgió en razón de la cantidad establecida de electrones para la estabilidad de un elemento, o sea, el átomo queda estable cuando presenta en su capa de valencia 8 electrones.
jueves, 11 de abril de 2013
Tipos de plasticos.
Tereftalato de Polietileno (PET)
Polipropileno (PP)
Polietileno de alta densidad (PEAD - HDPE)
Poliestireno (PS)
Policloruro de vinilo (PVC)
Polietileno de baja densidad (PEBD - LDPE)
Polipropileno (PP)
Polietileno de alta densidad (PEAD - HDPE)
Poliestireno (PS)
Policloruro de vinilo (PVC)
Polietileno de baja densidad (PEBD - LDPE)
lunes, 8 de abril de 2013
jueves, 4 de abril de 2013
Modelos de los números de oxidación.
1.- El numero de oxidación (Nox) es un numero entero que se asigna a cada elemento presente en una molécula. La finalidad es comparar su ambiente electrónico con el del mismo elemento en estado libre, es decir, sin combinar.
2.- Cualquier átomo en un elemento tiene numero de oxidacion cero.
3.- En toda molécula eléctricamente neutra, los números de oxidacion de los elementos que la constituyen es cero.
4.- La suma de los números de oxidacion de los átomos en una molécula cargada eléctricamente es igual a la carga de esta.
5.- Un elemento se oxida cuando en una reacción química su numero de oxidacion aumenta.
6.- Una disminución del numero de oxidacion de un átomo implica su reducción.
7.- Una limitación de este modelo es el suponer que los números de oxidacion corresponden a las cargas de los átomos en las moléculas. Como todo modelo, este es útil para los químicos. Sirve para comparar, clasificar, balancear, pero no para descubrir certeramente la distribución eléctrica en las moléculas. A pesar de que hay un comportamiento general existen importantes excepciones.
8.- Con los siguientes números de oxidación fijos se puede calcular los de muchas otras moléculas.
F Nox= -1 Siempre, excepto e el F2 donde es cero.
O Nox= -2 Casi siempre, excepto en el OF2 donde es +2,
en el agua oxigenada HOOH donde es -1 y,
desde luego en el O2 y O3 que es cero.
H Nox= +1 Casi siempre, excepto en los hidruros metálicos
(como el NaH o BeH2) donde es -1.
Cl, Br y I Nox= -1 Generalmente, excepto cuando están combinadas
con el oxigeno y el flúor. Además, cuando se
combinan entre si el elemento de menor numero
atómico es el que predomina.
N Nox= -3 Generalmente, excepto cando esta combinando
con el oxigeno y el flúor.
2.- Cualquier átomo en un elemento tiene numero de oxidacion cero.
3.- En toda molécula eléctricamente neutra, los números de oxidacion de los elementos que la constituyen es cero.
4.- La suma de los números de oxidacion de los átomos en una molécula cargada eléctricamente es igual a la carga de esta.
5.- Un elemento se oxida cuando en una reacción química su numero de oxidacion aumenta.
6.- Una disminución del numero de oxidacion de un átomo implica su reducción.
7.- Una limitación de este modelo es el suponer que los números de oxidacion corresponden a las cargas de los átomos en las moléculas. Como todo modelo, este es útil para los químicos. Sirve para comparar, clasificar, balancear, pero no para descubrir certeramente la distribución eléctrica en las moléculas. A pesar de que hay un comportamiento general existen importantes excepciones.
8.- Con los siguientes números de oxidación fijos se puede calcular los de muchas otras moléculas.
F Nox= -1 Siempre, excepto e el F2 donde es cero.
O Nox= -2 Casi siempre, excepto en el OF2 donde es +2,
en el agua oxigenada HOOH donde es -1 y,
desde luego en el O2 y O3 que es cero.
H Nox= +1 Casi siempre, excepto en los hidruros metálicos
(como el NaH o BeH2) donde es -1.
Cl, Br y I Nox= -1 Generalmente, excepto cuando están combinadas
con el oxigeno y el flúor. Además, cuando se
combinan entre si el elemento de menor numero
atómico es el que predomina.
N Nox= -3 Generalmente, excepto cando esta combinando
con el oxigeno y el flúor.
Suscribirse a:
Entradas (Atom)